Серная кислота – одна из самых сильных минеральных кислот, из-за высокой полярности связь Н – О легко разрывается.
- В водном растворе серная кислота диссоциирует, образуя ион водорода и кислотный остаток:
H2SO4 = H+ + HSO4-;
HSO4- = H+ + SO42-.
Суммарное уравнение:
H2SO4 = 2H+ + SO42-.
- Проявляет свойства кислот
 , реагирует с металлами, оксидами металлов, основаниями и солями.
, реагирует с металлами, оксидами металлов, основаниями и солями.
Разбавленная серная кислота не проявляет окислительных свойств, при ее взаимодействии с металлами выделяется водород и соль, содержащая металл в низшей степени окисления. На холоде кислота инертна по отношению к таким металлам, как железо, алюминий и даже барий.
Концентрированная кислота обладает окислительными свойствами. Возможные продукты взаимодействия простых веществ с концентрированной серной кислотой приведены в таблице. Показана зависимость продукта восстановления от концентрации кислоты и степени активности металла: чем активнее металл, тем глубже он восстанавливает сульфат-ион серной кислоты.
Fe, Cr, Al, (на холоде)
Fe + H2SO4 (конц., на холоде)
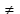
Тяжелые металлы
Cu + 2H2SO4 (конц.) = CuSO4 + SO2 + 2H2O
Щелочные и щелочно-земельные металлы, Al, Zn (при нагревании)
4Mg + 5H2SO4 (конц.) = 4MgSO4 + H2S + 4H2O
Металлы, стоящие в электрохимическом ряду напряжений металлов до водорода
2Al + 3H2SO4 (разб.) = Al2(SO4)3 +3H2
Металлы, стоящие в электрохимическом ряду напряжений металлов после водорода
Cu + H2SO4 (разб.)
Взаимодействие с оксидами:
CaO + H2SO4 = CaSO4 = H2O.
Взаимодействие с основаниями:
2NaOH + H2SO4 = Na2SO4 + 2H2O.
Взаимодействие с солями:
Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O.
- Окислительные свойства
Серная кислота окисляет HI и НВг до свободных галогенов:
H2SO4 + 2HI = I2 + 2H2O + SO2.
Серная кислота отнимает химически связанную воду от органических соединений, содержащих гидроксильные группы. Дегидратация этилового спирта в присутствии концентрированной серной кислоты приводит к получению этилена:
С2Н5ОН = С2Н4 + Н2О.
Обугливание сахара, целлюлозы, крахмала и др. углеводов при контакте с серной кислотой объясняется также их обезвоживанием:
C6H12O6 + 12H2SO4 = 18H2O + 12SO2↑ + 6CO2↑.