Экспериментальные исследования свидетельствуют, что вдали от критической температуры плотности жидкости и газа отличаются друг от друга в тысячи раз. Столь существенное количественное различие между жидкостью и газом неизбежно проявляется как качественное различие в поведении и свойствах жидких и газообразных систем.
Так, одним из важнейших свойств жидкостей, в отличие от газов, является их исключительно низкая сжимаемость.
Коэффициент сжимаемости жидкости χ определяется соотношением
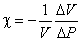 , , |
(6.6) |

Рис. 6.3 |
Исключительно низкая сжимаемость жидкостей наглядно иллюстрируется кривой Ван-дер-Ваальса
на участке АВ, который соответствует жидкой фазе (рис. 6.3). На рис. 6.3 видно, что для
незначительного уменьшения объема на участке АВ требуется очень большое увеличение
давления, следовательно, отношение 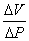 мало, а
значит, мал и коэффициент сжимаемости. Опыт показывает, что коэффициент сжимаемости жидкостей
в сотни тысяч раз меньше, чем для газов, и для большинства жидкостей лежит в
пределах 10-4 – 10-5 атм-1. Среди жидкостей
наибольшей сжимаемостью обладает жидкий гелий, у которого при давлении в несколько
атмосфер χ равен 8·10-3 атм-1.
Для воды χ = 4,53·10-5 атм-1,
ртути – 3,96·10-6 атм-1.
мало, а
значит, мал и коэффициент сжимаемости. Опыт показывает, что коэффициент сжимаемости жидкостей
в сотни тысяч раз меньше, чем для газов, и для большинства жидкостей лежит в
пределах 10-4 – 10-5 атм-1. Среди жидкостей
наибольшей сжимаемостью обладает жидкий гелий, у которого при давлении в несколько
атмосфер χ равен 8·10-3 атм-1.
Для воды χ = 4,53·10-5 атм-1,
ртути – 3,96·10-6 атм-1.
Коэффициент сжимаемости зависит от давления, уменьшаясь с ростом последнего. Это понятно, поскольку по мере того, как жидкость сжимается, уменьшается расстояние между ее частицами и увеличиваются силы отталкивания между ними, что и затрудняет дальнейшее сближение частиц. Следует отметить, что при высоких давлениях коэффициенты сжимаемости различных жидкостей практически одинаковы, несмотря на то, что их значения при обычных давлениях могут значительно различаться.
Можно ожидать, что с повышением температуры коэффициент сжимаемости жидкости должен возрастать. При нагревании вследствие теплового расширения объем жидкости увеличивается, и расстояния между молекулами возрастают. По этой причине силы отталкивания между частицами уменьшаются, и сжатие жидкости облегчается.
Совокупность опытных данных позволила получить эмпирическую формулу для коэффициента сжимаемости жидкости, которая имеет вид
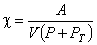 , , |
(6.7) |
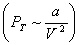 и
обусловленное взаимодействием молекул между собой.
и
обусловленное взаимодействием молекул между собой.
Из приведенного выражения для χ следует, что коэффициент сжимаемости жидкостей растет с повышением температуры и уменьшается с увеличением давления. Следует заметить, что приведенное соотношение для χ является приближенным и пригодно для сравнительно ограниченной области давлений.
Вещества, пребывающие в жидком состоянии с повышением температуры приобретают способность к тепловому расширению. Тепловое расширение вещества характеризуется коэффициентом объемного расширения:
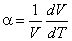 , , |
(6.8) |
Для различных жидкостей значения α при одинаковых температурах и давлениях могут изменяться весьма значительно. Так, при 20º С для воды α = 15·10-5 град-1, для бензола 124·10-5, для жидкой углекислоты 1050·10-5, глицерина 53·10-5 и т.д.
Из сказанного выше о влиянии изменения давления и температуры следует, что коэффициент объемного теплового расширения должен уменьшаться с повышением давления и расти с повышением температуры. Экспериментальные данные убедительно подтверждают справедливость этого утверждения. Действительно, с повышением температуры α сильно возрастает. Так, для жидкой углекислоты при повышении температуры от 0 до 20º С коэффициент теплового расширения возрастает вдвое.
В связи с изменением свойств жидкости при изменении температуры уместно отметить особенности в поведении воды. Большинство жидкостей при повышении температуры увеличивают свой объем, уменьшая при этом свою плотность. Вода отличается известной аномалией, состоящей в том, что в области температур от 0º С до 4º С повышение температуры приводит не к увеличению объема, а к его уменьшению, так что при 4º С вода обладает максимальной плотностью. Эта аномалия объясняется тем, что молекулы воды частично ассоциируют, то есть собираются в группы из нескольких молекул, образуя своеобразные большие молекулы. Вода состоит из трех типов молекул, соответствующих формулам H2O, (H2O)2 и (H2O)3, удельный объем которых различен. При разных температурах соотношение концентраций этих групп молекул различно. Этим и объясняется, что при определенной температуре (4º С) удельный объем воды имеет минимальное значение.
Рассматривая свойства жидкого состояния, имеет смысл остановиться на вопросе о теплоемкости жидкостей. Внутренняя энергия жидкостей, как это уже было отмечено ранее, определяется не только кинетической энергией теплового движения частиц, но и потенциальной энергией их взаимодействия, поэтому закономерности, которые были получены для идеальных газов, к жидкостям оказываются неприменимы.
Опыт показывает, что теплоемкость жидкостей зависит от температуры, причем эта зависимость у разных жидкостей различна. У одних жидкостей (и таких большинство) теплоемкость с повышением температуры увеличивается, а у других, наоборот, понижается. У некоторых жидкостей теплоемкость с повышением температуры сначала падает, а затем, пройдя через минимум, начинает расти. Именно такой ход теплоемкости наблюдается у воды.
Как и в газах, у жидкостей различают теплоемкости при постоянном объеме и постоянном давлении. Разность этих теплоемкостей СР – СV равна работе PdV (Р – молекулярное давление) моля жидкости при его нагревании на один градус, поэтому численное значение этой разности зависит от значения коэффициента объемного расширения жидкости. Значение СР – СV у жидкости не равно универсальной постоянной R, а может быть и меньше, и больше, в зависимости от значения α и от величины внутренних сил взаимодействия частиц жидкости, против которых совершается работа расширения.
Таким образом, теплоемкость жидкостей зависит от их молекулярной структуры. Жидкости с большим молекулярным весом обычно обладают большей теплоемкостью. Особенно это отчетливо проявляется для органических жидкостей, молекулы которых состоят из большого числа атомов легких элементов Н, О, С, N. Эти молекулы обладают большим числом степеней свободы и теплоемкость их велика. Теплоемкость таких жидкостей сильно зависит от температуры. Для органических жидкостей эта зависимость имеет вид
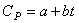 , , |
(6.9) |
Итак, теплоемкость жидкостей не может быть выражена такими простыми формулами, как теплоемкость идеальных газов. Численные значения теплоемкости могут быть самыми разнообразными.