Характерный вид структуры, который имеет данное вещество, определяется силами взаимодействия между его молекулами. Силы взаимодействия между молекулами имеют электромагнитную природу, хотя в целом молекулы электрически нейтральны. Но заряды в атомах и молекулах могут быть расположены не вполне симметрично, а как бы раздвинуты друг относительно друга, образуя подобие электрического диполя. А если такой асимметрии нет, то она может появиться в результате взаимодействия молекул. Количественно оценить силы взаимодействия между молекулами весьма трудно, поскольку каждая молекула содержит не по одной, а помногу заряженных частиц. Ясно только, что между молекулами могут действовать как силы притяжения, так и силы отталкивания. Силы притяжения в физике условились считать отрицательными, силы отталкивания – положительными.
Как показывают теория и опыт, и силы притяжения, и силы отталкивания очень сильно зависят от расстояния между центрами взаимодействующих молекул. Приближенно можно считать, что как те, так и другие обратно пропорциональны некоторой степени расстояния между молекулами, то есть
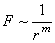 . . |
(6.1) |

Рис. 6.1 |
Различие между силами притяжения и отталкивания, помимо знака, заключается в значении показателя степени при r. Для сил притяжения m = 7, для сил отталкивания m принимает значения от 9 до 15. Из приведенных значений m следует, что силы отталкивания меняются с расстоянием значительно быстрее, поэтому они могут проявляться только при непосредственном сближении молекул. Качественная зависимость сил притяжения, сил отталкивания и результирующей силы взаимодействия между молекулами в зависимости от расстояния между ними приведена на рис. 6.1а.
Как видно из рис. 6.1а, при некотором значении 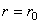 сила притяжения равна силе отталкивания и результирующая сила, действующая между молекулами,
равна нулю. Следовательно, потенциальная энергия взаимодействия молекул при
значении
сила притяжения равна силе отталкивания и результирующая сила, действующая между молекулами,
равна нулю. Следовательно, потенциальная энергия взаимодействия молекул при
значении 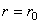 должна иметь минимальное
значение
должна иметь минимальное
значение 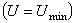 . В целом зависимость потенциальной
энергии взаимодействия молекул от расстояния между ними представлена на рис.6.1б и имеет вид
характерной потенциальной ямы, глубина которой определяется величиной
. В целом зависимость потенциальной
энергии взаимодействия молекул от расстояния между ними представлена на рис.6.1б и имеет вид
характерной потенциальной ямы, глубина которой определяется величиной 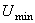 .
Величина
.
Величина 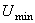 наряду с кинетической энергией
хаотического теплового движения
наряду с кинетической энергией
хаотического теплового движения 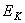 , которая
пропорциональна абсолютной температуре системы
, которая
пропорциональна абсолютной температуре системы 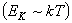 ,
определяет агрегатное состояние вещества.
,
определяет агрегатное состояние вещества.
При невысоких температурах, когда выполняется условие Umin >> kT, (глубокая потенциальная яма) вещество пребывает в твердом агрегатном состоянии. Если же потенциальная энергия взаимодействия молекул невелика (неглубокая потенциальная яма), а система находится при достаточно высокой температуре и характеризуется большой кинетической энергией теплового движения, так что выполняется условие Umin << kT, вещество находится в газообразном состоянии. В промежуточном случае, когда Umin порядка kT, вещество пребывает в жидком конденсированном состоянии.
Современная наука имеет гораздо менее отчетливое представление о строении жидкости, чем о строении газов и кристаллических тел, что объясняется большой сложностью явлений, характеризующих жидкость. По сути дела, полная и строгая теория жидкого состояния еще не создана. Сложность решения этой задачи во многом определяется особенностями строения жидкости.
Трудности рассмотрения кристаллов, обусловленные сильным взаимодействием частиц, в значительной степени компенсируются наличием упорядоченной структуры кристаллической решетки. Трудности рассмотрения газов, обусловленные разупорядоченностью положений отдельных частиц, компенсируются слабым межчастичным взаимодействием. В случае же жидкости имеют место обе указанные трудности при отсутствии в то же время соответствующих компенсирующих факторов. Дело в том, что молекулы в жидкости достаточно сильно взаимодействуют друг с другом. Однако учесть энергию этого взаимодействия при отсутствии строгого порядка в расположении молекул в жидкости оказывается весьма сложно, что в значительной степени затрудняет создание теории жидкого состояния.