Основной характеристикой атомов и молекул служит относительная атомная масса элемента
(сокращенно – атомная масса) и относительная молекулярная масса вещества
(сокращенно – молекулярная масса). За единицу атомной массы
выбрана 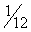 часть массы атома углерода.
часть массы атома углерода.
Атомной массой Аr химического элемента называется отношение массы атома этого элемента к 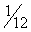 массы атома углерода.
массы атома углерода.
Молекулярной массой Mr вещества называется отношение массы молекулы этого вещества к 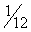 массы атома углерода. Ясно, что атомная и молекулярная масса – величины безразмерные.
массы атома углерода. Ясно, что атомная и молекулярная масса – величины безразмерные.
Как только что было определено, единица массы, равная 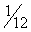 массы атома углерода, называется атомной единицей массы. Обозначим эту единицу, выраженную в килограммах, через mед. Тогда масса атома, выраженная в килограммах, будет равна Аrmед, а масса молекулы – Mrmед.
массы атома углерода, называется атомной единицей массы. Обозначим эту единицу, выраженную в килограммах, через mед. Тогда масса атома, выраженная в килограммах, будет равна Аrmед, а масса молекулы – Mrmед.
Количество вещества, в котором содержится число молекул, равное числу атомов в 0,012 кг углерода С, называется молем.
Число молекул, содержащихся в одном моле, называется числом Авогадро. Экспериментально определено, что число Авогадро
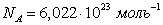 . . |

Лоренцо Романо Амедео Карло АВОГАДРО (1776-1856)
Итальянский физик и химик. Родился в Турине в дворянской семье, получил ученую степень доктора церковного права. В 1800 г. начал самостоятельно заниматься математикой и физикой, а спустя шесть лет получил должность профессора в колледже города Верчелли. Затем стал профессором кафедры математической физики Туринского университета. Авогадро был чрезвычайно скромным человеком, работал в одиночестве, и большую часть его жизни достижения Авогадро были неизвестны в научном мире.
Таким образом, в моле любого вещества содержится число Авогадро молекул. Массу моля, выраженную в килограммах, называют молярной массой и обозначают греческой буквой μ. Масса моля равна произведению NA на массу одной молекулы:
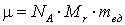 . . |
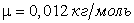 , а масса атома
равна 12mед. Подставляя эти значения в написанное выше соотношение, получим:
, а масса атома
равна 12mед. Подставляя эти значения в написанное выше соотношение, получим:
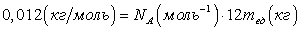 . . |
 . . |
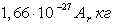 . . |
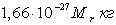 . . |
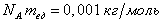 .
.Подставляя это в формулу
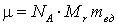 . . |
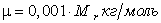 . . |
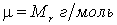 . . |
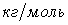 или в
или в 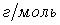 .
.
Если вещество состоит из молекул, образованных из атомов различных химических элементов, то молекулярная масса данного вещества равна сумме атомных масс элементов, входящих в состав данного вещества. Так молекулярная масса воды Н2О, состоящая из двух атомов водорода и одного атома кислорода, будет равна
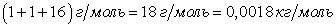 . . |
Возьмем 1 см3 Н2О. Его масса 1 г. Один моль воды содержит 18 г.
Таким образом, 1 см3 воды содержит 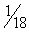 моля. Следовательно, 1 см3 содержит
моля. Следовательно, 1 см3 содержит 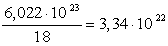 молекул воды.
молекул воды.
Таким образом, в жидкой воде на долю одной молекулы приходится объем
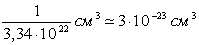 . . |
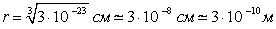 . . |
Линейные размеры других атомов и молекул представляют собою величины порядка 10-8 см, или, что то же самое, 10-10 м. Массу m одной молекулы любого вещества можно найти из соотношения
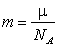 . . |
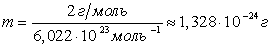 . . |
Это очень маленькая величина, однако, масса электрона в тысячи раз меньше.
Чтобы нагляднее представить себе размеры атомов молекул и их количество в определенном объеме вещества, вот два интересных примера:
1) наименьшие размеры частиц, доступные рассмотрению в оптический микроскоп, содержат примерно 10 миллиардов атомов;
2) если все атомы, находящиеся в 1 см3 меди, расположить в одну линию плотно друг к другу, то длина такой цепочки будет примерно 14 миллиардов километров. Это примерно в 90 раз больше, чем расстояние от Земли до Солнца.